酸性の水溶液 + アルカリ性の水溶液→塩+水 塩はしおと読まずにえんと読むので注意。 中和の計算問題では,ほとんどが 塩酸 +水酸化ナトリウム水溶液 →食塩(塩化ナトリウム) + 水 についての計算問比重を利用する溶液の計算問題 薄める水の量を求める問題 溶液の質量パーセント濃度やモル濃度についてはすでに説明してありますのでここでは比重も含めた計算問題と求め方を紹介します。 濃度の定義についてはそれほど難しさは感じないと思いますが問題は計算ですね。 何故難しく感じるかというと、後につながらない計算方法でやっているからです。 化学計算式 必要な原液量(mL)=希釈液の濃度(%) / 原液の濃度(%) × 作成する希釈液の量(mL) 必要な原液量(mL)=作成する希釈液の量(mL) / 希釈液の倍率 ※計算結果や情報等に関して当サイトは一切責任を負いません。また個別相談は対応しません。
画像をダウンロード 水溶液 の 計算 シモネタ
水溶液 の 計算
水溶液 の 計算-この水溶液500mLを上記の水酸化ナトリウム水溶液で滴定したところ,175mLで中和点に達した。 (1) 水酸化ナトリウム水溶液のモル濃度を求めよ。 (2) 希釈前の食酢中の酢酸のモル濃度を求めよ。 (3) 希釈前の食酢の質量パーセント濃度を求めよ水溶液ではなく「水」となっていることに注意してください。 水溶液は水+質量なので、水溶液は=0gです。 40÷0×100= 答え %
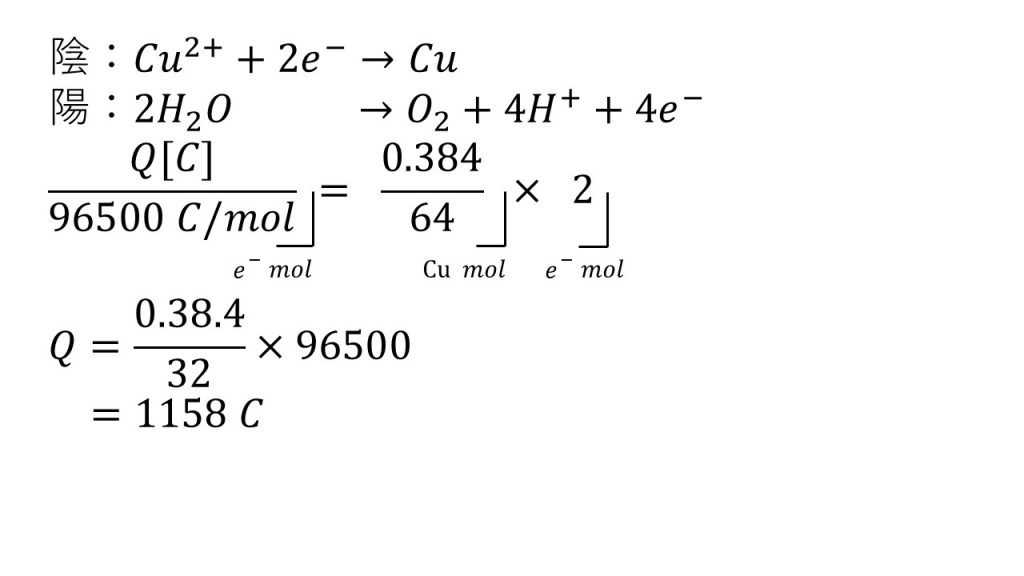



電気分解の計算 問題と答え 大学受験の王道
Dec 22, · 水溶液は濃度を求める計算が非常に大切です。 ここで、全体・部分・割合の関係を理解することは、中学で学ぶこと全ての基本とも言えます。 しっかり学んで身につけておきたいところですからこのページを参考に整理してください。トリウム水溶液すいようえき を10cm3 加えたとき 過不足かふそく なく中和ちゅうわがおこり,水溶液は中性 になる。さらに,うすい水酸化ナトリウ ム水溶液 5cm3 を加えると( 合計で 15cm3),水溶液はアルカリ性になる。 (2)「ある濃度消毒薬の希釈液の作り方 消毒薬の使用において,期待する殺菌効果を得るためには使用濃度を正確に守る必要がある。 しかし消毒薬にはいろいろな濃度のものがあり,使用濃度に希釈して用いる時に混乱することが多い。 一般にA%の消毒薬を希釈してB
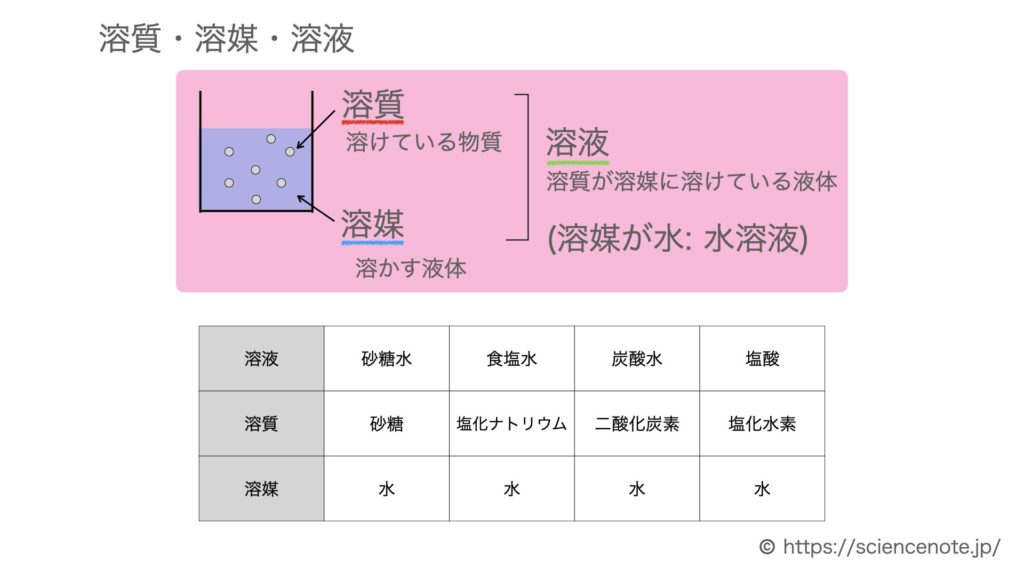
Author 松下俊雄 Created Date 8/27/18 AM70℃で135g溶解している飽和水溶液を30℃まで冷却すると,30℃では45gしか溶解できないので 135-45=90 g析出します。 また,70℃のときの飽和水溶液は100+135=235 gです。水溶液の濃度 濃度とは、水溶液の濃さのことです。正式には、 質量パーセント濃度 といいます。パーセントで溶けている物質の割合を表したもの
透析液計算 ※単位のL →dLの換算が必要となるので注意! 濃度が585mg/dlのNaCl(分子量:58.5)水溶液中のNa+の当量濃度はいくつか。 濃度が1170 mg/dLのNaCl(分子量:585)水溶液の当量濃度はいくつか。 濃度が1110 mg/dLのCaCL2(分子量:111)水溶液のいろいろな物質1 いろいろな物質2 密度 水溶液 水溶液2 気体 気体2 計算問題 質量パーセント濃度1 質量パーセント濃度2 質量パーセント濃度3 質量パーセント濃度4 質量パーセント濃度5 質量パーセント濃度6 質量パーセント濃度7 溶解度1 溶解度2 溶解度3 溶解度4 密度 密度2 密度3Jul 18, · 実は非常に厄介なことがあって、水とアルコールを混ぜると、少し体積が減るのである。 50ccの100%アルコールに純水を加えて行き、100ccになった時というのは、実際には水はおよそccが足されている。



水溶液と質量パーセント濃度の計算問題 Sciencenote Jp




中学1年生 理科 水溶液の性質 練習問題プリント 無料ダウンロード 印刷 ちびむすドリル 中学生
Jan 09, · ここまで来たらほとんどゴールです! 95×13/5を計算すれば、必要な水の量が分かります。 答えは 247g 。 13gの塩化水素で 5% の塩酸を作りたい場合は、 247g の水を用意しましょう。水溶液の体積から水溶液を調製するために必要 な水酸化カリウムの質量と溶解水の体積を求め る場合(図1)や、調製前の水酸化カリウムkoh の質量と溶解水の体積から水溶液の濃度を計算 する場合(図2)には、2つのテキストボックスMar 13, · 水溶液の濃さ 中学受験〜高校受験の理科(化学)に対応する、一問一答問題集です。 水溶液の濃さの計算や溶解度についての問題を40問収録しています。



基礎化学3 溶液



水溶液と質量パーセント濃度の計算問題 Sciencenote Jp
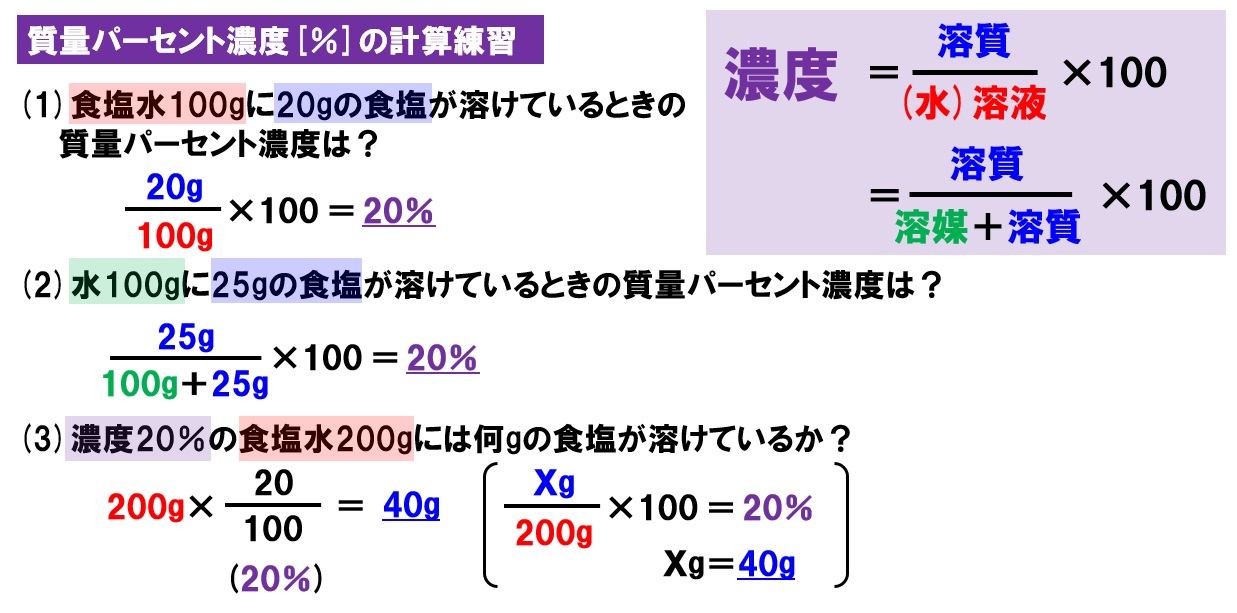
この値を上の式にあてはめて計算するとモル濃度がわかります。 1114 g/mL x 1,000mL x 100w/w%/100 ÷ 7813 = 1426mol/L このように濃度を求めるには「比重(または密度)」「純度(または含量)」「分子量」の3点がわからなければなりません。100gの塩化ナトリウム水溶液になる。 このとき 溶質10g, 溶液 (溶媒溶質)100gなのでNov 09, 19 · 塩分濃度 (%) = 塩 / 水溶液 = 塩 / (水+塩) よって、100gの水に5gを溶かしても5%ではありません (476%)。



濃度の応用



中1理科 水溶液と濃度 水溶液の性質と濃度計算 Pikuu
<水溶液の濃度にまつわる練習問題> (1) 食塩3g が溶かされている食塩水50g の濃度は何%ですか。 濃度( % ) = 溶質( 𝐠 ) 溶液( 𝐠 ) × 100 = 溶質( 𝐠 ) 溶媒 + 溶質( 𝐠 ) × 100 この公式をまず覚えET水溶液のDSC線図 融解潜熱に関する過去の研究 DSC (Differential Scanning Calorimetry) 示差走査熱量計 0℃ 図.純水のDSC線図 6 日本熱物性学会研究分科会 「低温環境における熱物性の基礎と応用」 08/ 9/ 5 DSCを用いた過去の研究 図.初期濃度10wt%の ET水溶液のDSC線図計算には滴定結果の平均値を用いる。 操作4 濃度未知の酢酸ch3cooh 水溶液100 ml をホールピペットで取り,メスフラスコ に入れた。そして,標線まで水を加えて100 ml の水溶液にした。この水溶液をc 液と する。 c 液;濃度未知の酢酸水溶液を100 倍に薄めたもの
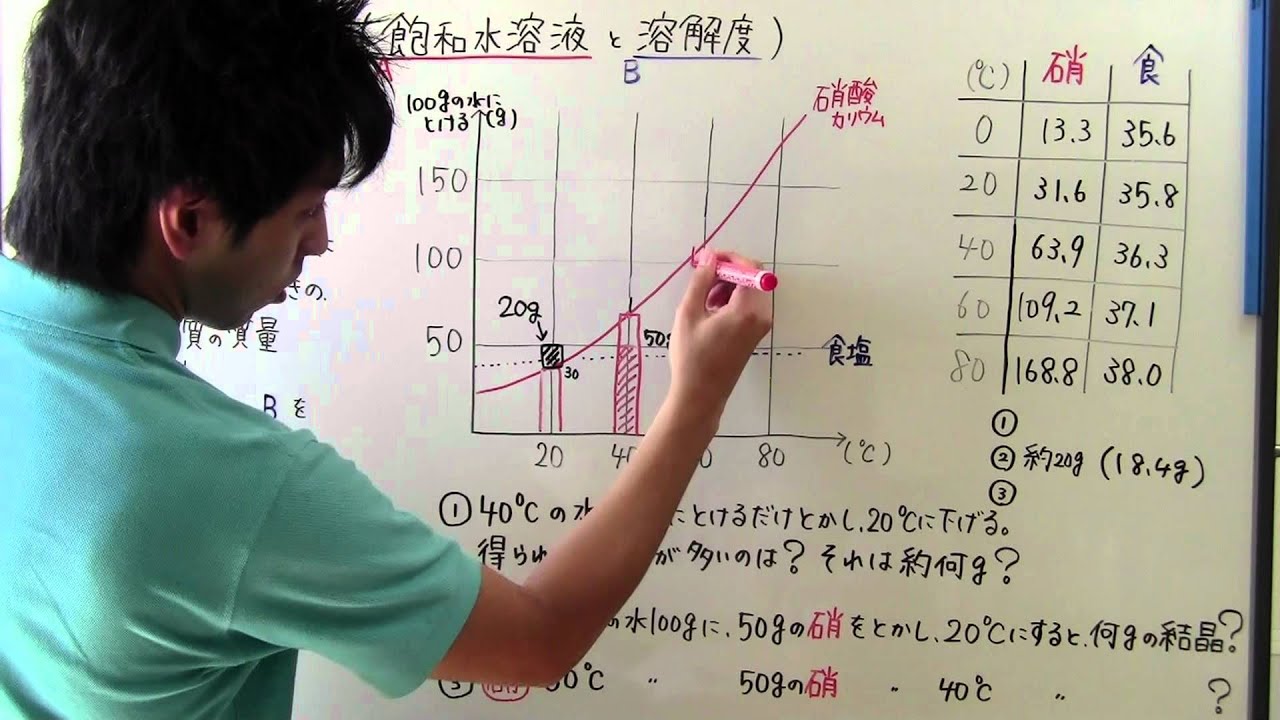



中1 理科 中1 34 飽和水溶液 溶解度 Youtube




4番教えてください 計算の仕方がわからないです Clear
までの塩化マグネシウム水溶液に適用できる式と濃度が52 mol kg−1 までの塩化カルシウム水溶液に 適用できる式を用いた。いずれの水溶液に関しても01 mol kg−1 から40 mol kg−1 まで01 mol kg−1 刻み で浸透係数やイオンの平均活量係数を計算した。Jun 05, 15 · %の食塩水、 %の砂糖水といった、水溶液の「濃度」についての計算問題プリントです。 苦手な人が多いけど、しっかり身につけよう! 数学でも役に立つ場面があるよ(^ ^)酸、或は、塩基を含む(混合)水溶液17種類のpH、それに、各溶液成分の濃度分率を計算します。溶液中の水素イオン濃度 H は、酸(或は、塩基)の解離平衡式、各成分の質量保存則、それに、それらの電荷均衡式とから導き出される、水素イオン濃度 H に関する代数方程式から求めています。




中1理科 水溶液 濃度の計算が10分で理解できる たけのこ塾 勉強が苦手な中学生のやる気をのばす




高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月
Jul 21, 03 · 水溶液の比重の計算方法を教えてください。たとえば、塩水について。おねがいします。お困りのようで、お役に立てるかどうか判りませんが 思いつくままに書きます。私は食品系・化学分析系ではありません(熱力・流力系)故、勘違いや的Jul 09, 19 · 水溶液の性質と質量パーセント濃度の計算‥「溶液」「溶質」「溶媒」の意味 中学理科で習う水溶液の性質から濃度の計算方法を中心に紹介します。 濃度の計算は、試験に頻出する項目のひとつです。 しっかり覚えましょう。 「溶質」「溶媒」「溶液」とは?Jun 13, 19 · 理科の化学範囲、水溶液の濃さと溶解度について、濃さの計算方法とてんびん図による濃さの求め方、溶解度曲線の読み方などを解説しています。解説動画、演習プリント、オンラインテストもありますのでご利用ください
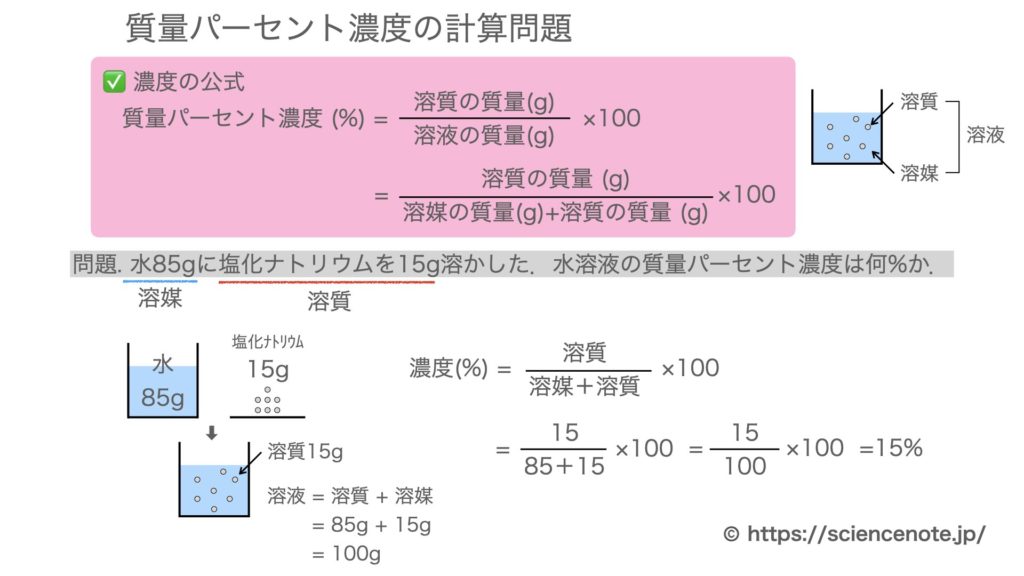



水溶液と質量パーセント濃度の計算問題 Sciencenote Jp




中1理科 濃度の計算 映像授業のtry It トライイット
May 18, 21 · 出典 フリー百科事典『ウィキペディア(Wikipedia)』 ( 0844 UTC 版) 希薄水溶液のpH 適度な濃度(1 mol/L ないし 1 μmol/L、すなわち 10 0 10 −6 mol/L)の水溶液のpHは、酸・塩基のモル濃度から計算することができる。 必要に応じて、酸解離定数 K a 、塩基解離定数 K b 、水のイオン積 K w をJul 02, 19 · 質量パーセント濃度の公式と計算問題の解き方 水85gに塩化ナトリウムを15g溶かした.水溶液の質量パーセント濃度は何%か 水は溶媒で85g,塩化ナトリウムは溶質で15g. これらを合わせると,塩化ナトリウム水溶液100gできます. したがって, 濃度 = 溶質 ÷ 溶液 ×100 = 15g ÷ 100g ×100 = 15% となります.ナトリウム水溶液は何mLか計算せよ. (8) 10 %(w/v)の塩化ナトリウム水溶液と,10 %(w/v)クエン酸水溶液を水で希 釈して,「塩化ナトリウムを2 %(w/v),クエン酸を5 %(w/v)含む混合水溶




酸と塩基 Phの計算 酸性水溶液 ブリリアンス化学 Youtube




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ
2 塩化マグネシウム六水和物のモル質量を計算しておく. 3 水溶液をつくるために必要な塩化マグネシウムが何molなのかを計算する. 4 それは塩化マグネシウム六水和物と同じ物質量. 5 モルから重さを求める 質量 = (物質量)(モル質量)Apr 07, · 溶媒が水の場合 、溶液は 水溶液 と呼ばれます。食塩水の場合、溶質・溶媒・溶液は次のようになります。 溶質食塩;Jan 01, 18 · 必要薬液量は上記の計算で求められます。10%塩化ナトリウム水溶液を何mlかの水で薄めて02%塩化ナトリウム水溶液を500mlで作っているので、もともとの薬液量がわかれば、 「作成した水溶液」―「もともとの薬液量」=「使用した水分量」 で求められます。
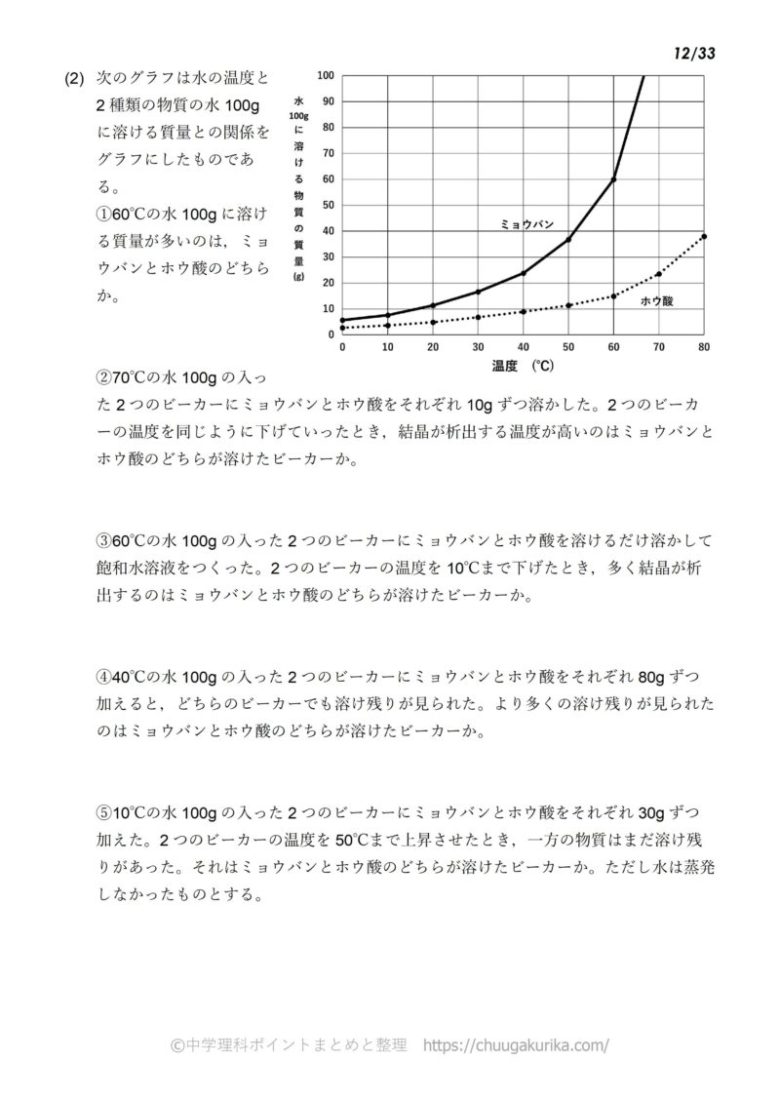



中1化学 溶解度の計算問題 中学理科 ポイントまとめと整理



受験化学 10 溶解度の計算2 みかみの参考書ブログ




中和滴定による濃度の決定について計算式の意味がわかりません 理科 苦手解決q A 進研ゼミ高校講座
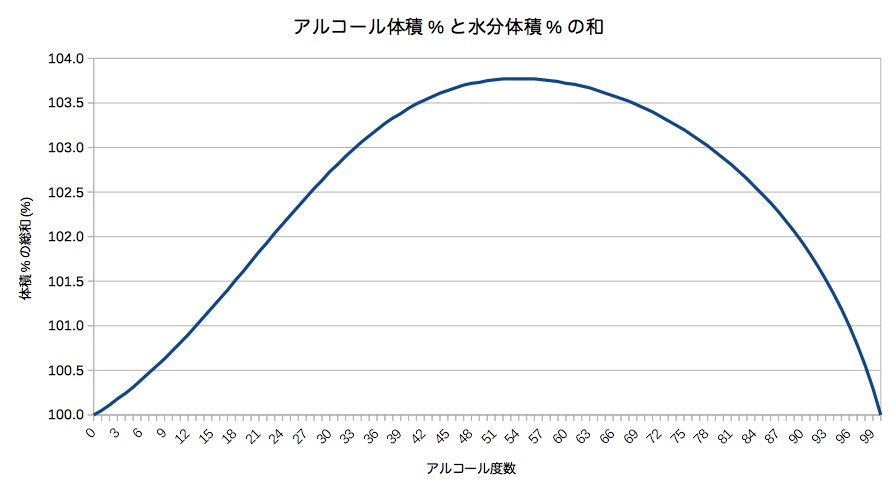



エタノール水溶液の度数と密度から水分体積 アルコール質量 比重を計算する 私は何から出来ているのか



受験化学 9 溶解度の計算1 みかみの参考書ブログ




水溶液濃度 水を蒸発させたときの物質の質量計算 中学数学 理科 寺子屋塾の復習サイト




強酸と強塩基を混合した後のph計算問題
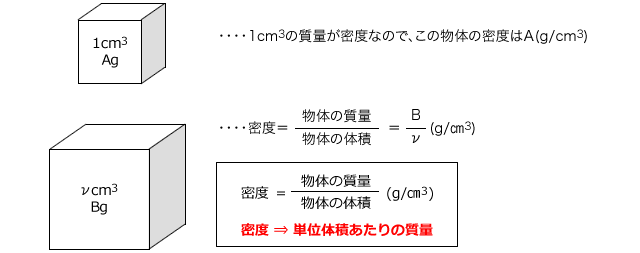



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム



看護学科の化学講義 16 溶液濃度計算問題演習 Life Chemistry




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく
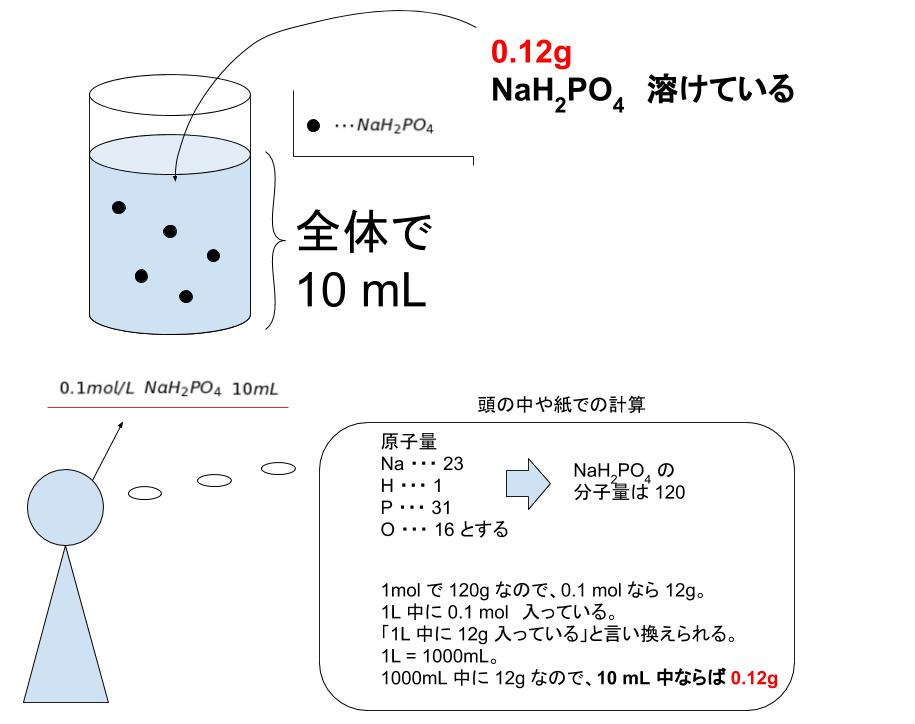



溶液の濃度計算 薬学 これでok



画像をダウンロード 水溶液 の 計算 シモネタ
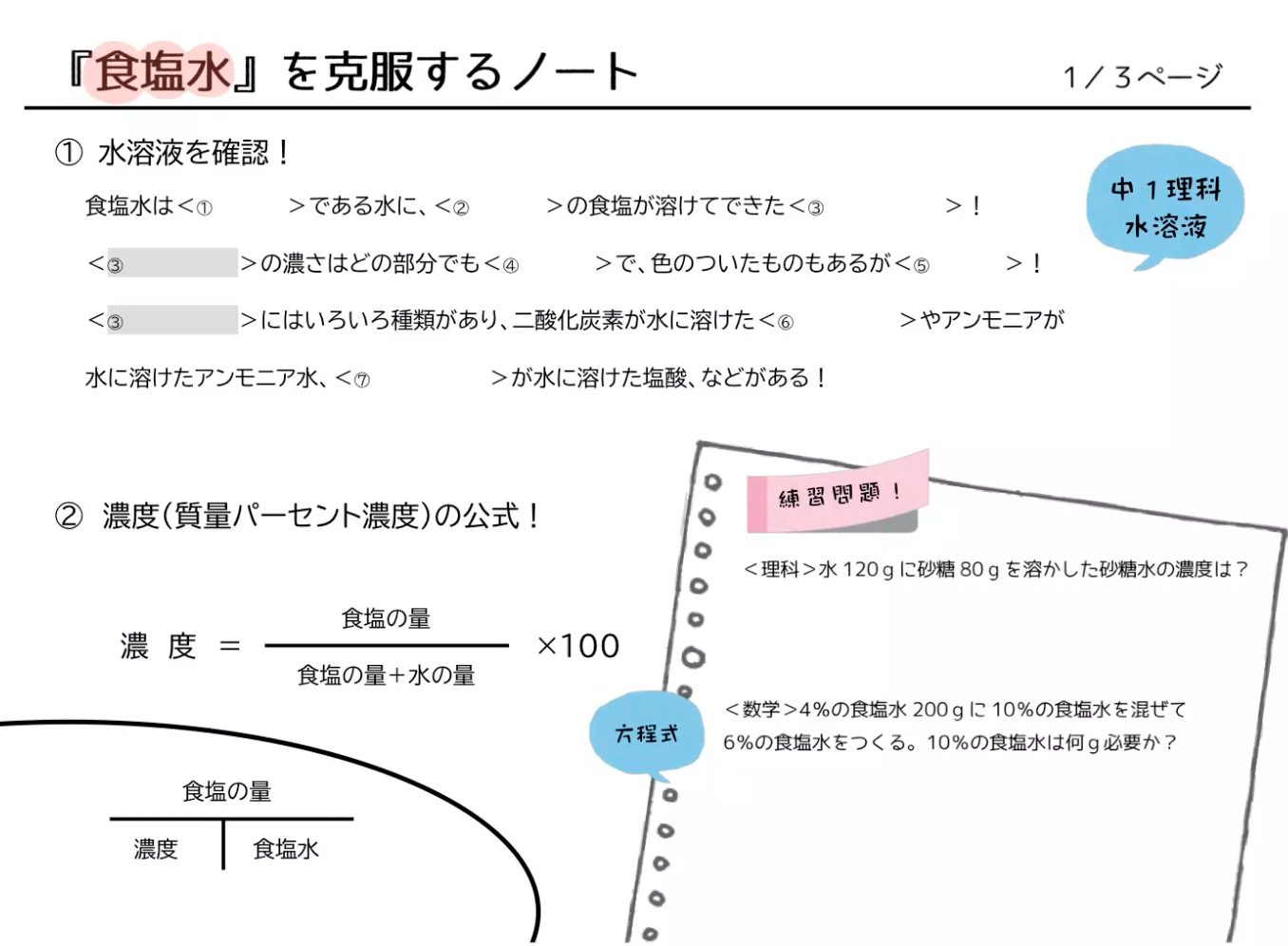



中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン




固体の溶解度 温度との関係 計算問題 溶解度曲線など 化学のグルメ




中1理科 溶解度 溶解度曲線とは 計算問題の解き方 グラフの読み取り方 映像授業のtry It トライイット
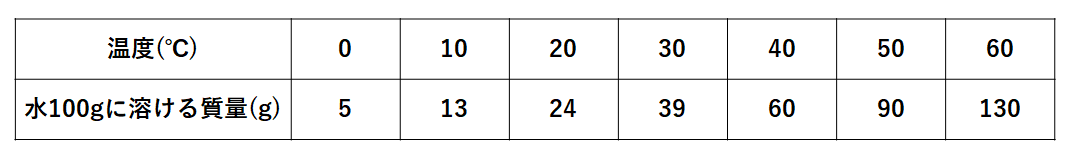



中1化学 溶解度の計算問題 中学理科 ポイントまとめと整理




4 6 溶液の濃度 おのれー Note



1




1 30g 3100g See How To Solve It At Qanda




質量パーセント濃度の計算問題集 基本編 Menon Network
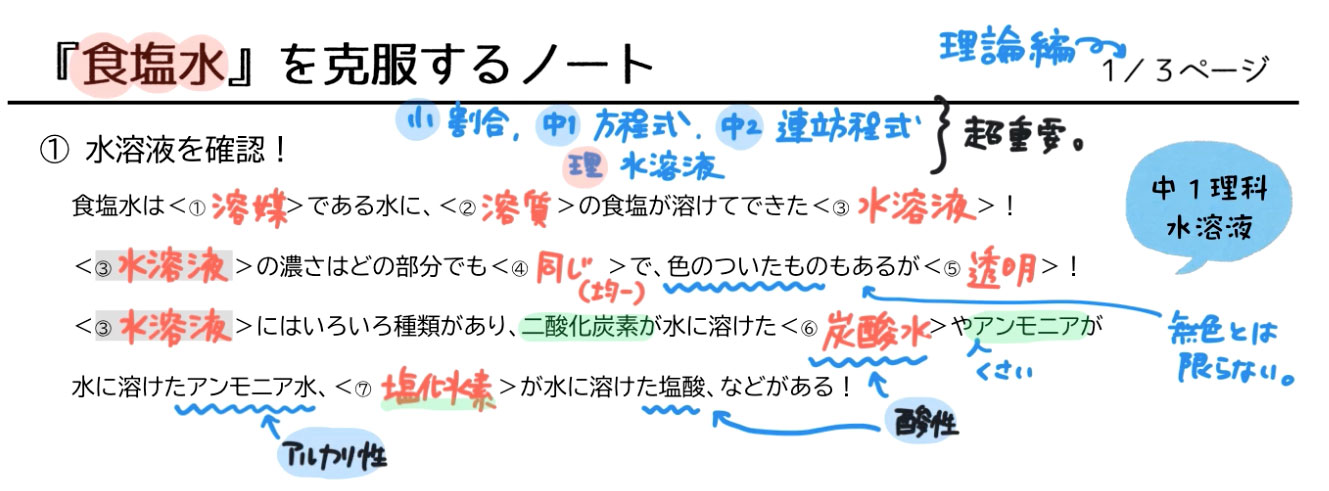



中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン



画像をダウンロード 水溶液 の 計算 シモネタ



中1化学 水溶液 濃度 中学理科 ポイントまとめと整理




中学受験理科講座 水溶液の濃さと溶解度




中1 理科 中1 32 質量パーセント濃度 Youtube



実習21 水溶液の濃度 1年理科 化学 Takaの授業記録12




4 6 溶液の濃度 おのれー Note




中学受験理科講座 水溶液の濃さと溶解度
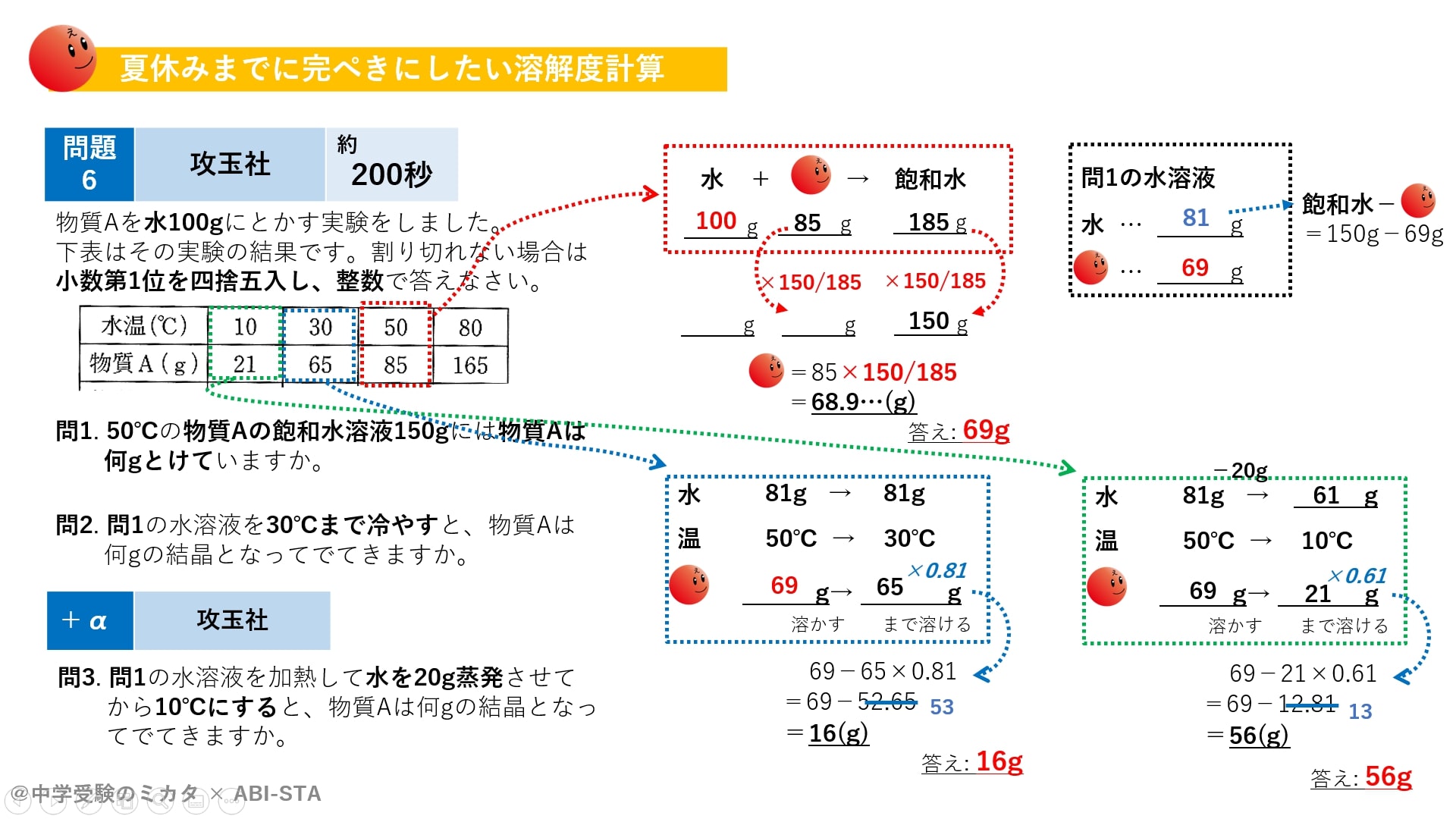



Mh4eivt2tjn1um
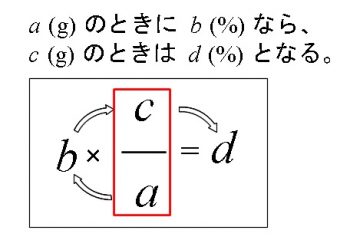



溶液の質量パーセント濃度の求め方と比重を利用した計算問題




中1理科 溶解度 溶解度曲線とは 計算問題の解き方 グラフの読み取り方 映像授業のtry It トライイット




中学理科 水溶液の濃度と飽和 溶解度 偏差値40プログラマー




理容師美容師国家試験の水溶液の計算で悩む方のために パターン3 最終日 地震とアスペルガー




中1理科 水溶液の計算問題 中学生 理科のノート Clear



溶質を求める
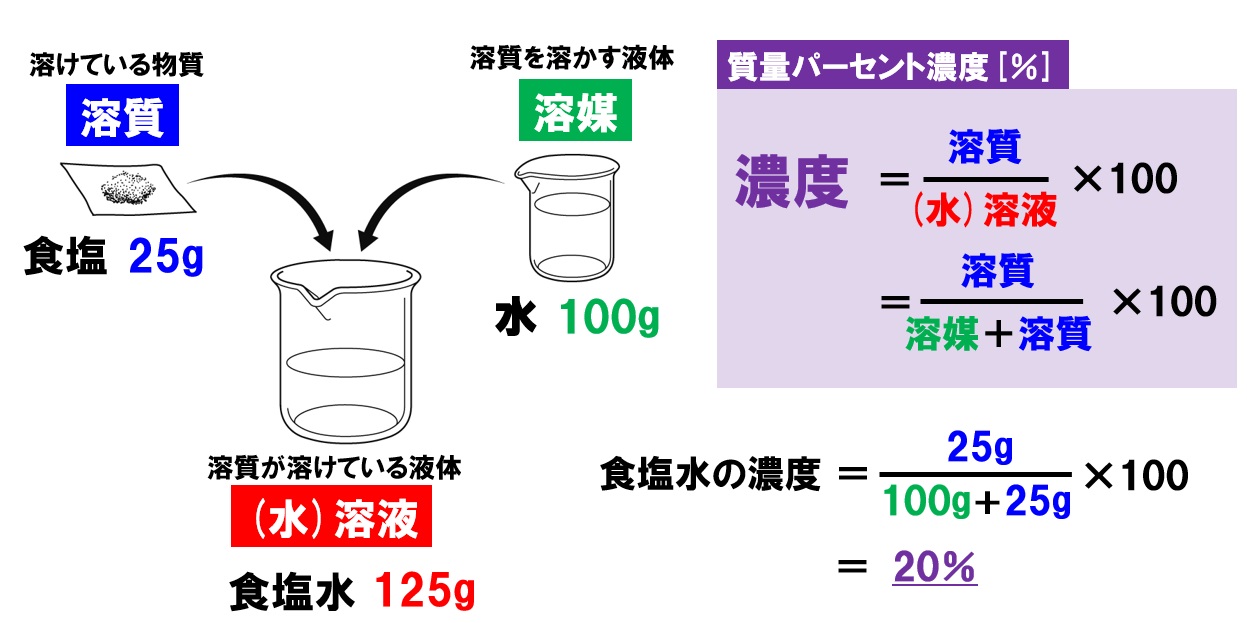



中1理科 水溶液と濃度 水溶液の性質と濃度計算 Pikuu




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




この問題の一つ目の モル濃度を求める計算の部分で 1 1 11と 1 1000が何を Clear




Pdf 濃度の計算ドリル45題 中学理科ポイントまとめと整理 オンラインショップ
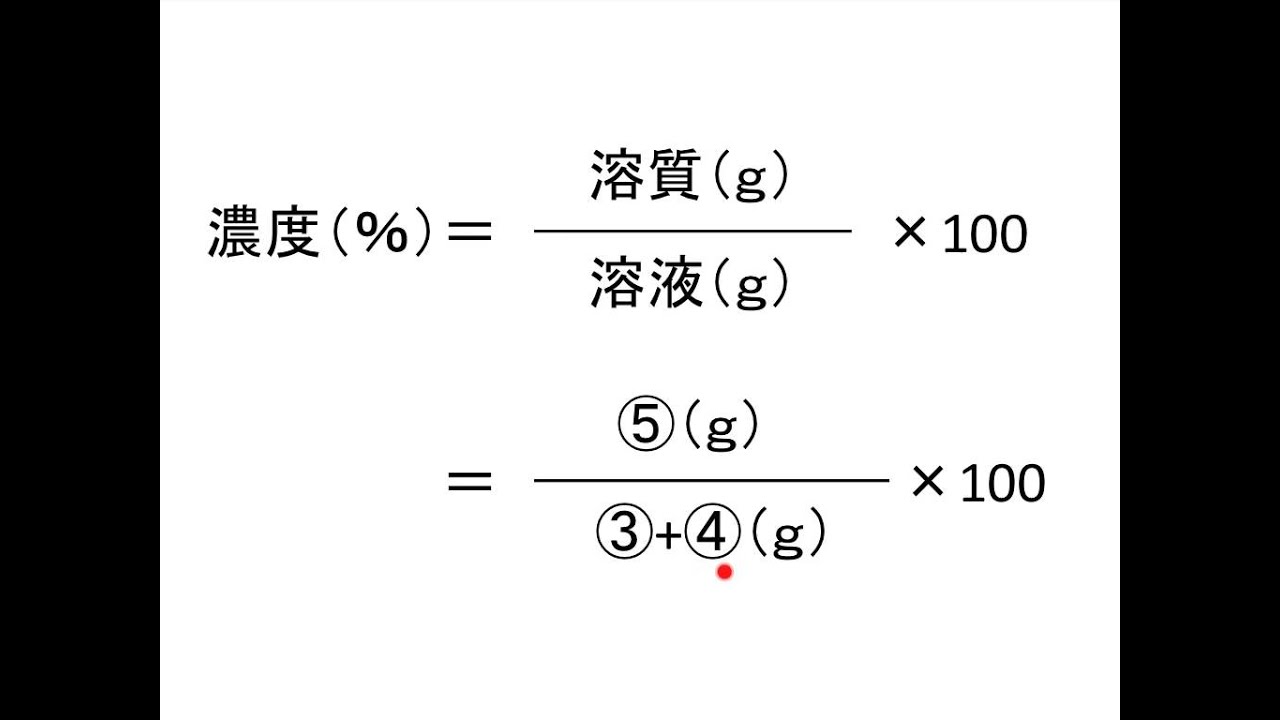



濃度の求め方 絵で覚えよう Youtube
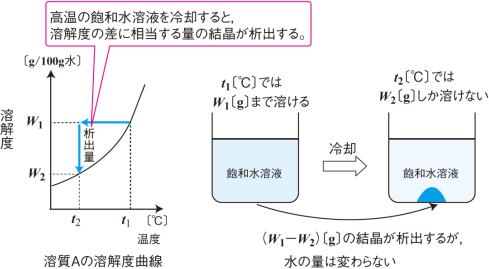



溶液の性質 飽和溶液を冷却したときの結晶の析出量の計算方法を教えてください 化学 定期テスト対策サイト




Pdf 濃度の計算ドリル45題 中学理科ポイントまとめと整理 オンラインショップ




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット




高校化学基礎 濃度の計算 練習編 映像授業のtry It トライイット




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




質量パーセント濃度の計算問題集 基本編 Menon Network
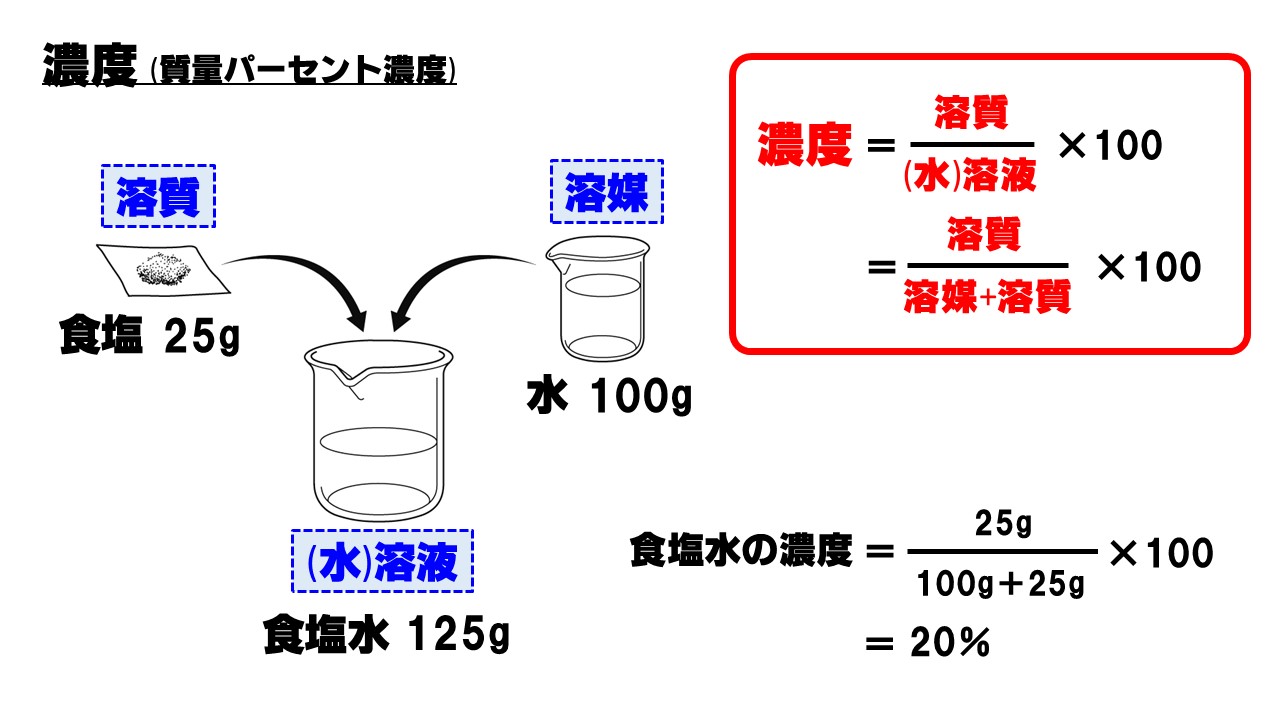



エレガント質量 パーセント 濃度 最高のぬりえ



1
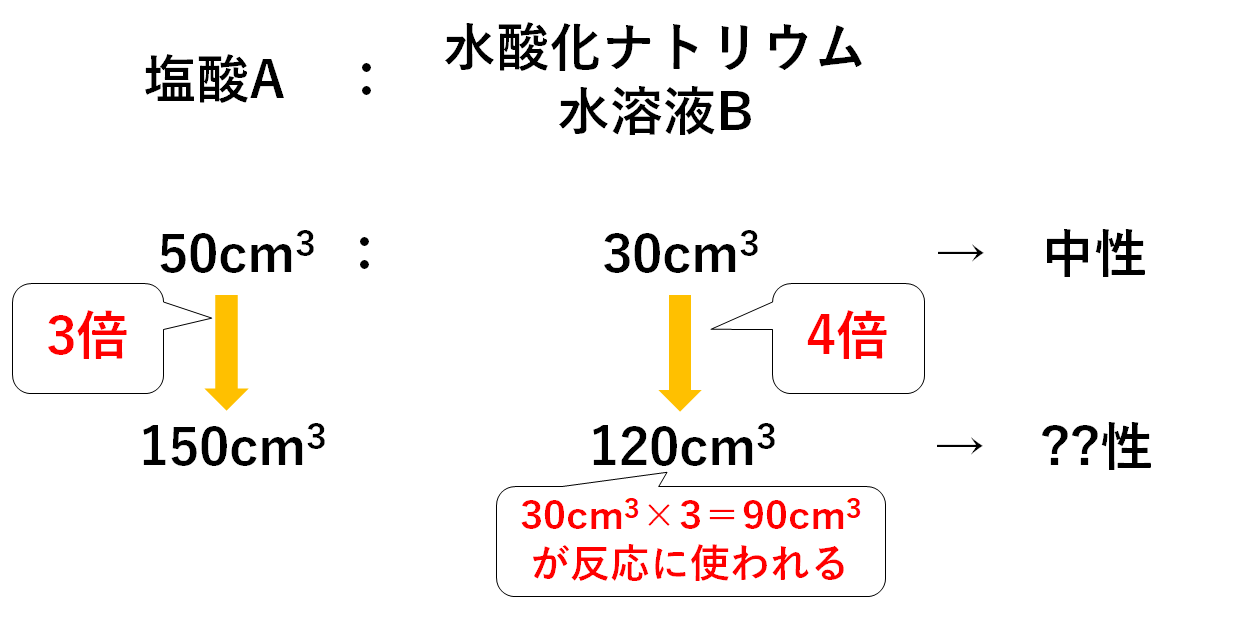



中3化学 中和の量的関係 中学理科 ポイントまとめと整理




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




1 30g 0g Descubre Como Resolverlo En Qanda




質量パーセント濃度の計算問題集 応用編 Menon Network
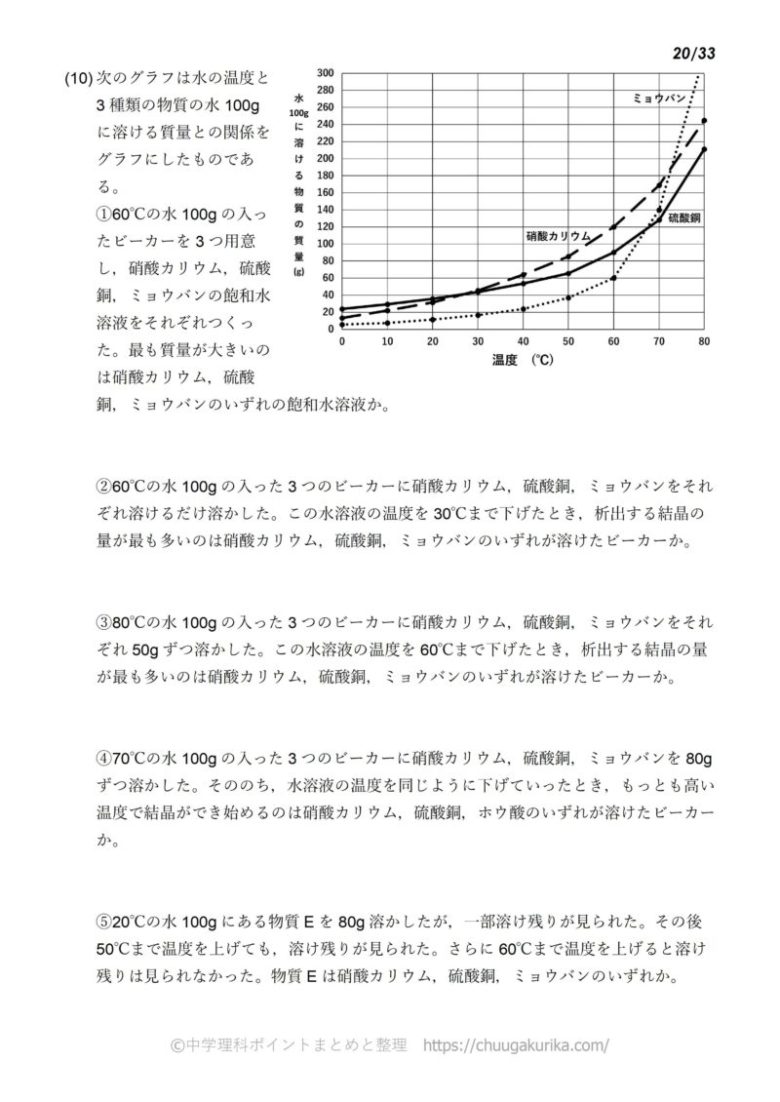



中1化学 溶解度の計算問題 中学理科 ポイントまとめと整理
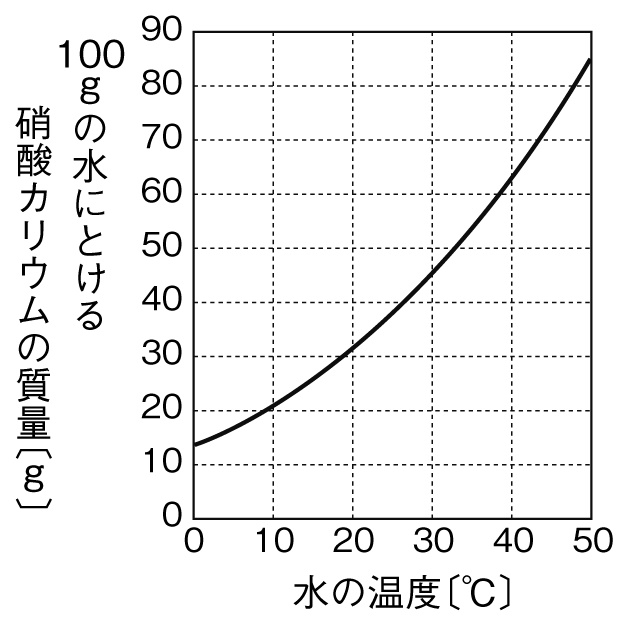



定期テスト対策問題 質量パーセント濃度の計算演習問題 Examee




モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ
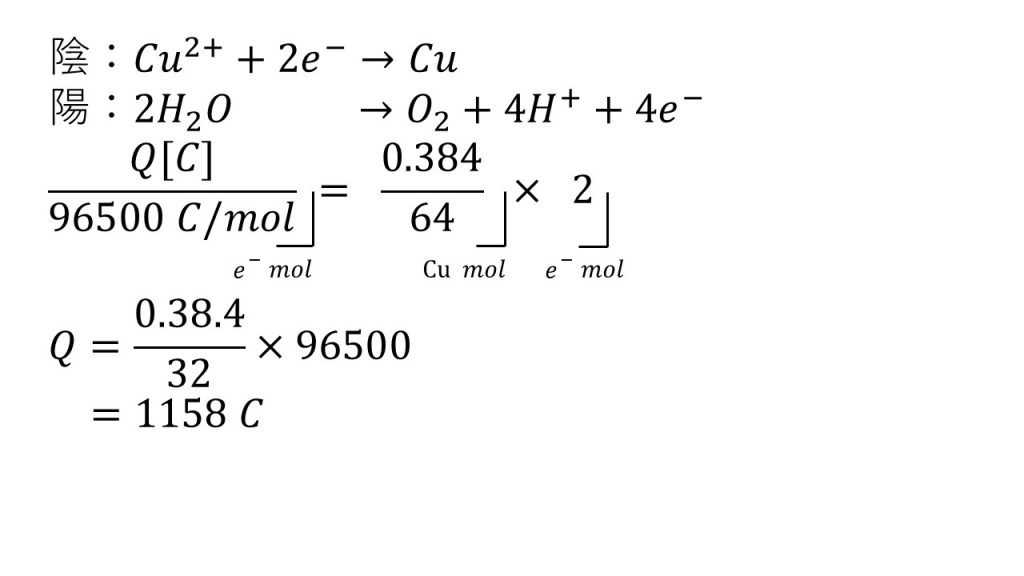



電気分解の計算 問題と答え 大学受験の王道
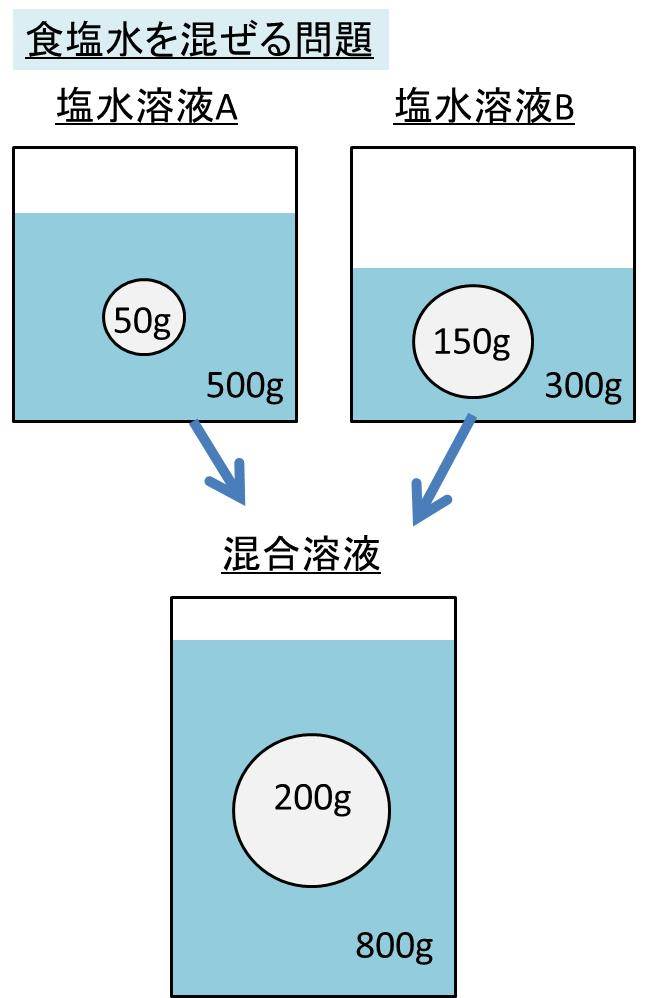



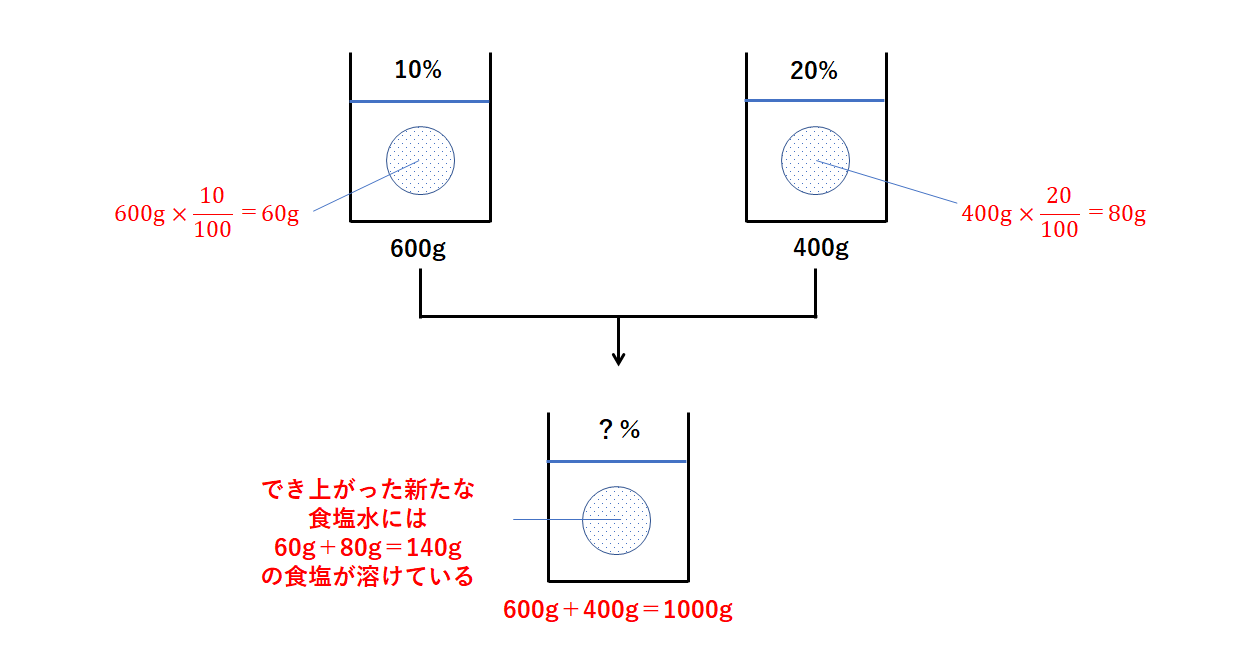
Spi 異なる濃度の食塩水を混ぜる問題の計算方法 濃度算
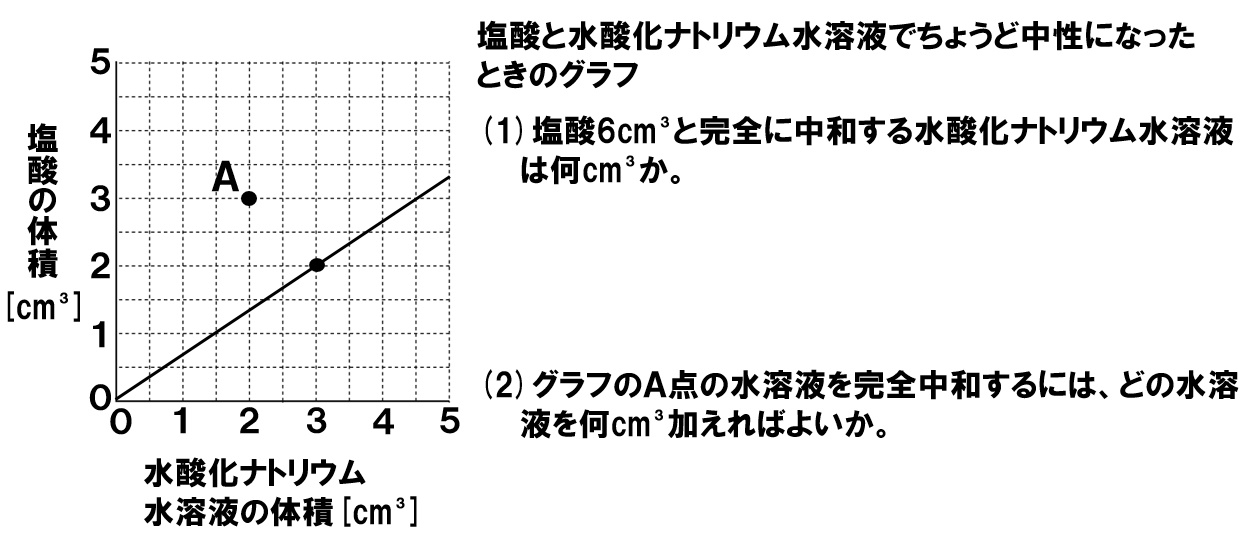



中3理科 完全中和の計算 Pikuu




食塩水問題 濃度算 の2つの解き方とポイントを図で解説 数学fun
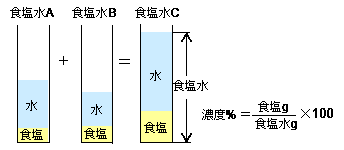



濃度算 混ぜる 高精度計算サイト



中1理科 水溶液 濃度の計算が10分で理解できる たけのこ塾 勉強が苦手な中学生のやる気をのばす
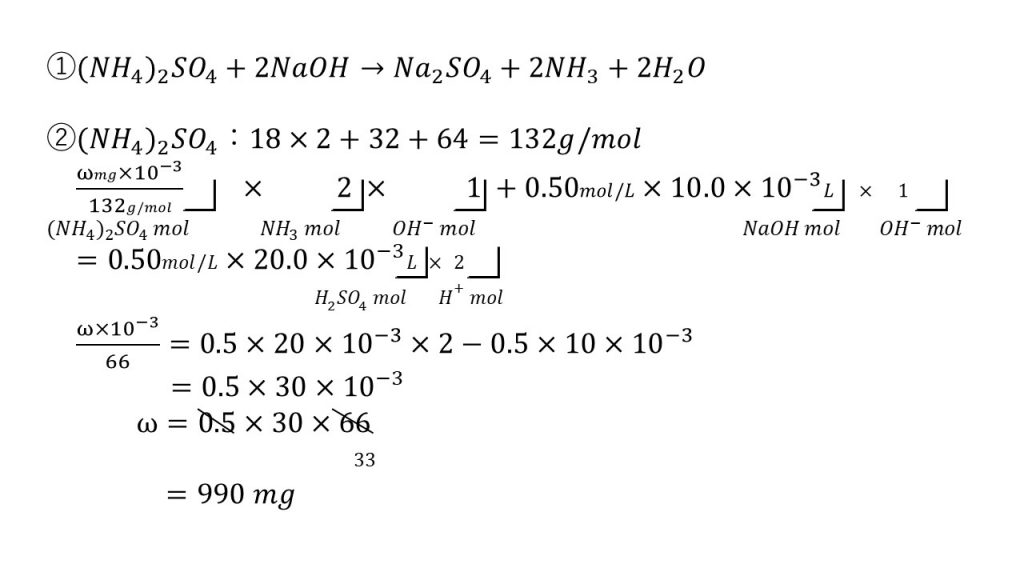



中和 phの計算 応用 問題と答え 大学受験の王道



中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




理科 中1 27 質量パーセント濃度 Youtube




濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン




モル計算 濃度計算などの問題 解説 レベルa2 ともよし塾 受験と科学の解説授業




看護学科の化学講義 16 溶液濃度計算問題演習 Life Chemistry




高校理論化学 食酢中の酢酸のモル濃度と質量パーセント濃度 受験の月




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




中1 理科 化学 濃度の計算方法 14分 Youtube
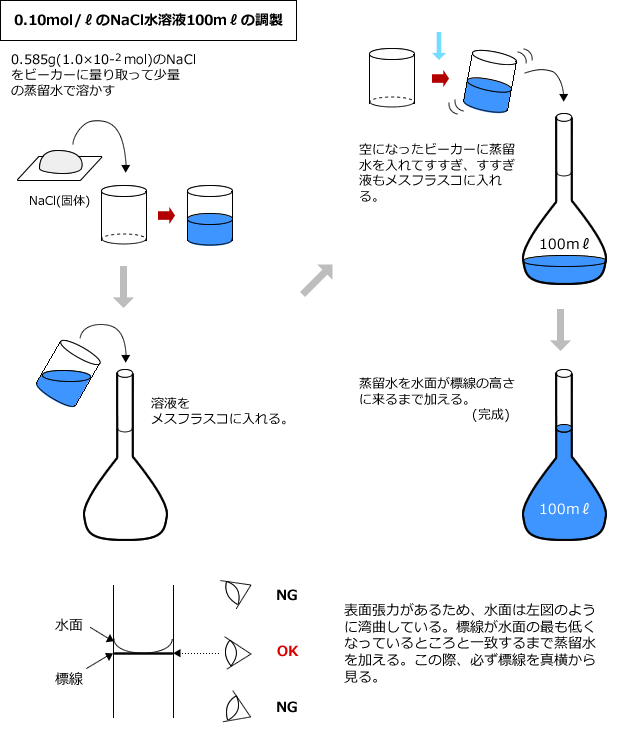



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム



1




水溶液の性質と質量パーセント濃度の計算 溶液 溶質 溶媒 の意味 中学理科要点 Yattoke 小 中学生の学習サイト




質量パーセント濃度の計算問題集 基本編 Menon Network




理容師美容師国家試験の水溶液の計算で悩む方のために パターン2 地震とアスペルガー




溶解度とは 求め方の秘訣 溶解度曲線も図で即理解 計算問題付き 高校生向け受験応援メディア 受験のミカタ



1
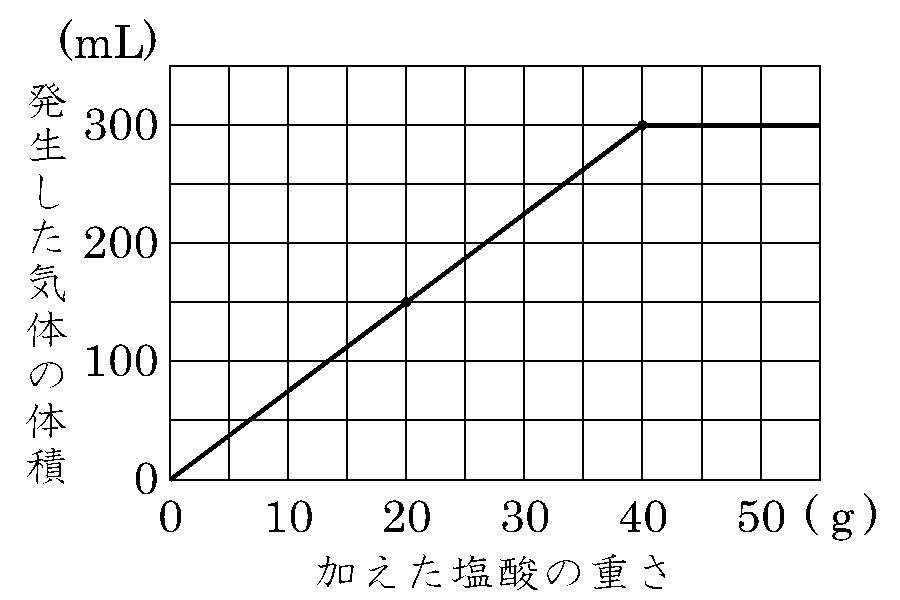



こうして学べば必ずわかる 中学受験 理科




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく
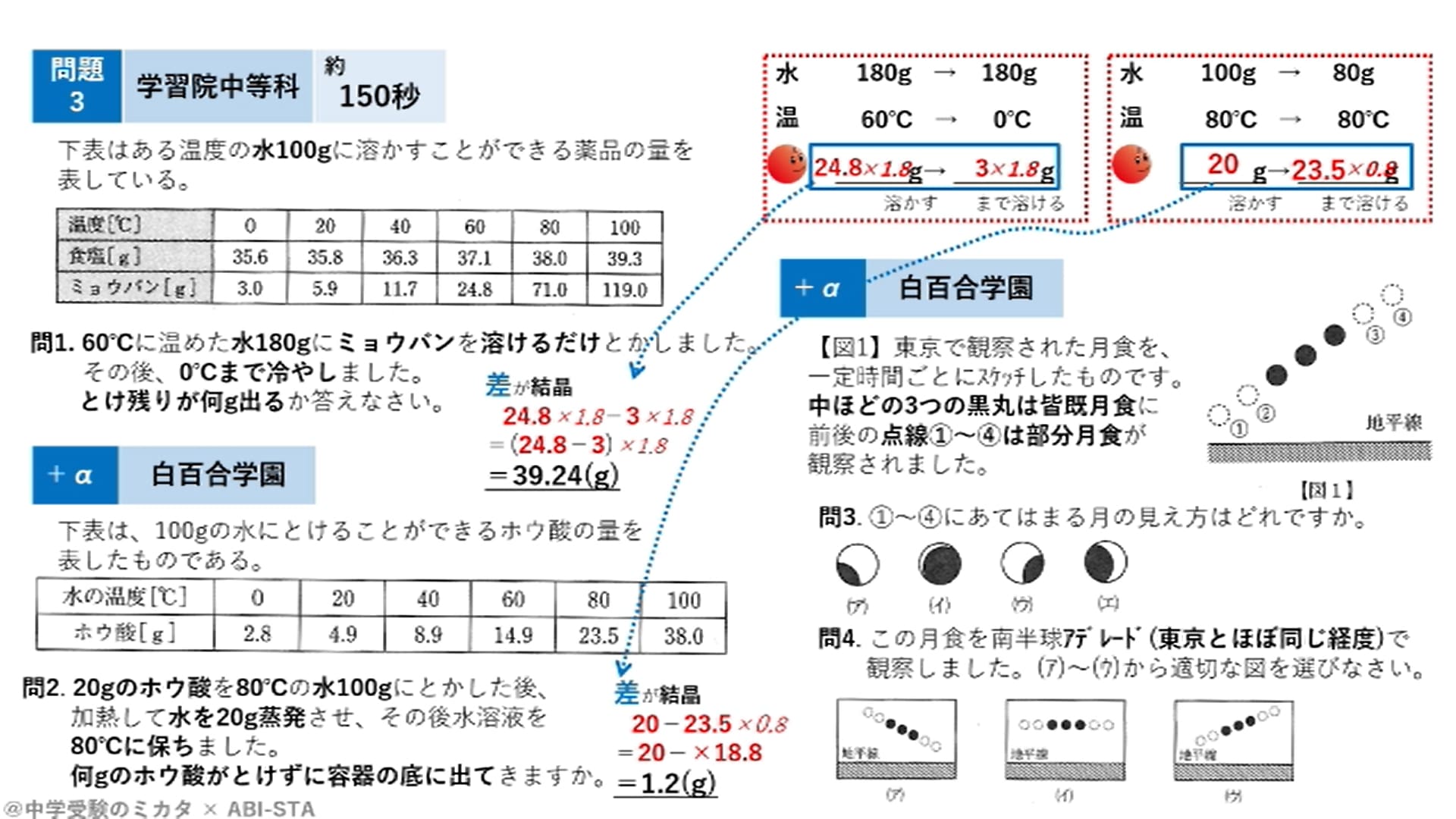



塾内模試によく出る飽和水溶液の溶解度計算




中学1年生 理科 水溶液の性質 練習問題プリント 無料ダウンロード 印刷 ちびむすドリル 中学生




中和の計算問題 無料で使える中学学習プリント
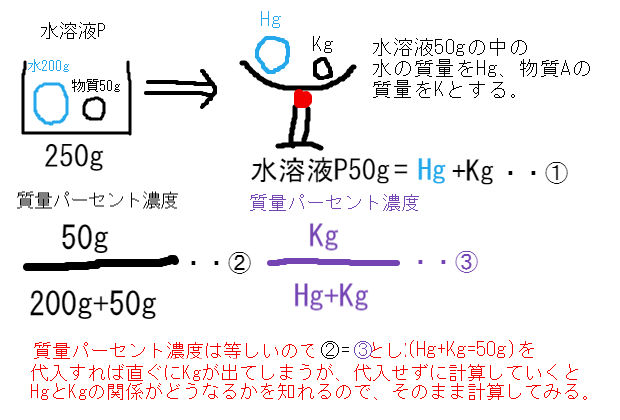



水溶液濃度 水を蒸発させたときの物質の質量計算 中学数学 理科 寺子屋塾の復習サイト




中学1年生 理科 水溶液の性質 練習問題プリント 無料ダウンロード 印刷 ちびむすドリル 中学生



中1理科の水溶液の計算問題が分かりません 求め方と 答えまで教え Yahoo 知恵袋




高校化学 水和物の再結晶 映像授業のtry It トライイット




2 で 単位の計算で なぜcm 3が消えたのでしょうか Clear
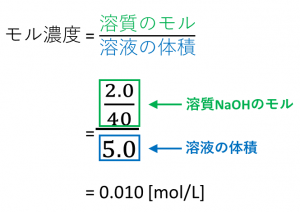



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine




質量パーセント濃度の計算問題集 応用編 Menon Network



0 件のコメント:
コメントを投稿